การตรวจวัดเมอคิวรี (II) ไอออนด้วยโรดามีน 6 จี ไฮดราไซด์ บนวัสดุรองรับที่เป็นอนุพันธ์ของพอลิเมอร์จากธรรมชาติ
คำสำคัญ:
เมอคิวรี (II) ไอออน , โรดามีน 6 จี ไฮดราไซด์ , เซลลูโลสไตรอะซิเตทบทคัดย่อ
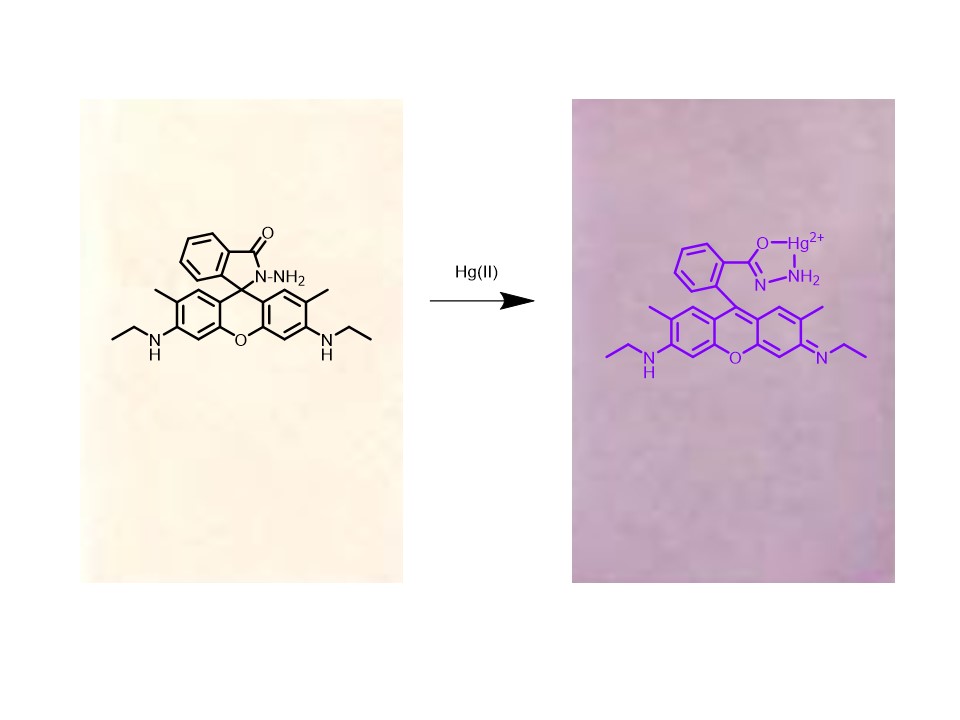
วัตถุประสงค์และที่มา : เมอคิวรี (II) ไอออน (Hg2+) เป็นไอออนโลหะที่มีความเป็นพิษสูง แม้ปนเปื้อนในแหล่งน้ำเพียงเล็กน้อยก็จะส่งผลต่อสุขภาพของสิ่งมีชีวิต องค์การอนามัยโลก (WHO) ได้กำหนดปริมาณปรอทอนินทรีย์ในน้ำดื่มมีค่าไม่ควรเกิน 29.9 นาโนโมลาร์ ดังนั้นจึงมีความจำเป็นอย่างยิ่งในการพัฒนาชุดตรวจวัดเมอคิวรี (II) ไอออน ในงานวิจัยนี้ต้องการพัฒนาชุดตรวจวัดไอออน Hg2+ ในรูปแบบของแผ่นฟิล์มที่เป็นมิตรต่อสิ่งแวดล้อม โดยแผ่นฟิล์มนี้เตรียมได้จากการผสมโรดามีน 6 จี ไฮดราไซด์ (L6G) กับวัสดุรองรับเซลลูโลสไตรอะซิเตท (CTA) ซึ่งเป็นอนุพันธ์ของเซลลูโลส และมี Tris (2-ethylhexyl) Phosphate (TEHP) เป็นพลาสติไซเซอร์ เนื่องจากได้มีการรายงานมาก่อนหน้านี้ว่าโมเลกุล L6G มีความจำเพาะเจาะจงในการเลือกจับกับไอออน Hg2+ ได้เป็นอย่างดีในตัวทำละลายเททระไฮโดรฟิวแรน 10% จึงทำให้ไม่สามารถนำโมเลกุล L6G มาตรวจวัด Hg2+ ไอออนในตัวอย่างที่เป็นน้ำได้ ซึ่งทางคณะผู้วิจัยคาดว่าแผ่นฟิล์ม L6G ที่เตรียมขึ้นมานี้สามารถนำมาใช้ตรวจวัด Hg2+ ไอออนในตัวอย่างที่เป็นน้ำได้
วิธีดำเนินการวิจัย : ฟิล์ม L6G เตรียมโดยใช้วิธี casting จากการผสมโรดามีน 6 จี ไฮดราไซด์ (L6G) กับเซลลูโลส ไตรอะซิเตท (CTA) และมี tris(2-ethylhexyl) phosphate (TEHP) เป็นพลาสติไซเซอร์ การศึกษาความจำเพาะเจาะจงในการตรวจวัดไอออนโลหะทำได้โดยนำฟิล์มที่เตรียมได้ไปแช่ในสารละลายของโลหะชนิดต่าง ๆ การตรวจวัดความเข้มสีของฟิล์มที่เปลี่ยนแปลงทำได้โดยใช้โปรแกรม Image J นอกจากนี้ยังได้ทำการศึกษาหาสภาวะที่เหมาะสมในการเตรียมฟิล์ม ได้แก่ การศึกษาปริมาณของ CTA ที่เหมาะสม การศึกษาปริมาณของ TEHP ที่เหมาะสม และการศึกษาปริมาณของลิแกนด์ ที่เหมาะสม และยังได้ศึกษาสภาวะที่เหมาะสมในการนำแผ่นฟิล์มไปใช้เป็นชุดตรวจวัด ได้แก่ การศึกษาเวลาที่เหมาะสมในการตรวจวัด การศึกษาผลของ pH ที่เหมาะสมในการตรวจวัด การศึกษาความเข้มข้นของสารละลายไอออนของโลหะที่เลือกจับกับฟิล์ม L6G ที่สามารถตรวจวัดได้ รวมไปถึงการศึกษาการศึกษาค่าขีดจำกัดการตรวจวัดและการศึกษาปริมาณเมอคิวรี (II) ไอออนต่ำสุดที่สามารถวัดได้
ผลการวิจัย : จากการศึกษาสภาวะที่เหมาะสมในการเตรียมฟิล์ม L6G ด้วยสภาวะที่เหมาะสมพบว่าฟิล์มที่เตรียมได้มีลักษณะเป็นแผ่นฟิล์มที่มีลักษณะเรียบสีชมพูซีดไม่ละลายน้ำ เมื่อนำฟิล์มที่เตรียมได้ไปศึกษาความจำเพาะเจาะจงของการตรวจวัดไอออนโลหะที่ละลายอยู่ในน้ำนั้น พบว่าฟิล์มดังกล่าวมีความจำเพาะเจาะจงในการตรวจวัดไอออน Hg2+ ที่ละลายอยู่ในน้ำได้เป็นอย่างดี เนื่องจากมีเพียงไอออน Hg2+ เท่านั้นที่เปลี่ยนสีของฟิล์มจากสีชมพูซีดไปเป็นสีม่วง การเปลี่ยนแปลงดังกล่าวเกิดจากการที่ไอออน Hg2+ เกิดพันธะโคออร์ดิเนตโควาเลนต์กับลิแกนด์ L6G ที่อยู่ในฟิล์ม โดยลิแกนด์ L6G ใช้อะตอมของออกซิเจนและไนโตรเจนเป็นอะตอมผู้ให้อิเล็กตรอนแล้วจึงเหนี่ยวนำให้เกิดการเปิดของวงสไปโรแลกแตม จึงทำให้แผ่นฟิล์มเปลี่ยนสีจากสีชมพูซีดไปเป็นสีม่วง จากการศึกษาหาสภาวะที่เหมาะสมในการเตรียมฟิล์ม L6G พบว่า ปริมาณของ CTA ที่เหมาะสมที่สุด คือ 0.2 กรัม จะได้ฟิล์มที่มีความใส และมีความหนาที่เหมาะสม ถ้ามีปริมาณของ CTA น้อยเกินไปจะได้ฟิล์มที่มีลักษณะบาง แต่ถ้ามีปริมาณ CTA สูงเกินไปจะทำให้ได้ฟิล์มที่หนาปริมาณของ TEHP ที่เหมาะสมที่สุด คือ 0.05 กรัม โดยที่ถ้ามีปริมาณของ TEHP ที่มากเกินไปจะได้ฟิล์มที่มีลักษณะแข็งและด้านซึ่งส่งผลให้น้ำไม่สามารถซึมผ่านเข้าไปได้ สำหรับปริมาณของลิแกนด์ L6G ที่เหมาะสมที่สุดในการเตรียมฟิล์ม คือ 6.0 มิลลิกรัม เนื่องจากให้ค่าความเข้มสีสูงที่สุด ถ้ามีปริมาณของ L6G มากเกินไปฟิล์มที่จะได้จะมีลักษณะขุ่นไม่มีความเป็นเนื้อเดียวกัน จากการศึกษาหาสภาวะที่เหมาะสมในการตรวจวัดไอออน Hg2+ ที่ละลายอยู่ในน้ำด้วยฟิล์ม L6G พบว่าเวลาที่เหมาะสมในการแช่ฟิล์ม L6G ในสารละลายของไอออน Hg2+ คือ 180 นาที pH เท่ากับ 5.0 โดยตรวจวัดที่ 0 นาที หรือหลังจากนำฟิล์ม L6G ขึ้นมาจากสารละลาย ซับให้แห้ง แล้วทำการวัดความเข้มสีบนแผ่นฟิล์มทันที โดยที่วัสดุดังกล่าวสามารถตรวจวัดความเข้มข้นของไอออน Hg2+ ที่มีความเป็นเส้นตรงในช่วงความเข้มข้นระหว่าง 1.0-10.0 ppm มีค่าขีดจำกัดการตรวจวัดเท่ากับ 0.51 ppm และปริมาณความเข้มข้นของไอออน Hg2+ ต่ำสุดที่สามารถตรวจวัดได้มีค่าเท่ากับ 1.66 ppm จากการศึกษาช่วงความเข้มข้นของไอออน Hg2+ ที่สัมพันธ์กับความเข้มสีของฟิล์มที่วัดได้มีความเป็นเส้นตรงมากที่สุดพบว่าอยู่ในช่วง 0-10 ppm มีค่า R2 = 0.9984 การศึกษาการศึกษาค่าขีดจำกัดการตรวจวัดและการศึกษาปริมาณเมอคิวรี (II) ไอออนต่ำสุดที่สามารถวัดได้ด้วยแผ่นฟิล์ม L6G พบว่ามีค่า 0.51 ppm และ 1.66 ppm ตามลำดับ
สรุปผลการวิจัย : ในงานวิจัยนี้ได้พัฒนาเซ็นเซอร์ทางเคมีเชิงแสงในรูปแบบของแผ่นฟิล์มสำหรับการตรวจวัดไอออน Hg2+ ที่ละลายอยู่ในน้ำ โดยใช้ลิแกนด์โรดามีน 6G ไฮดราไซด์ (L6G) เป็นโมเลกุลเซ็นเซอร์ที่ผสมกับเซลลูโลสไตรอะซิเตตหรือ CTA ด้วยวิธี casting และมี THEP ทำหน้าที่เป็นพลาสติไซเซอร์ ชุดตรวจวัดที่เตรียมได้นี้มีลักษณะเป็นฟิล์มบางใสมีสีชมพูอ่อน ไม่ละลายน้ำและมีความคงทนเมื่ออยู่ในน้ำ จากการศึกษาความจำเพาะเจาะจงในการตรวจวัดไอออนของโลหะชนิดต่างๆ ของฟิล์มที่เตรียมได้ พบว่าฟิล์มดังกล่าวมีความจำเพาะเจาะจงกับไอออน Hg2+ ได้เป็นอย่างดี เนื่องจากมีเพียงไอออน Hg2+ เท่านั้นที่ทำให้สีของฟิล์มเปลี่ยนจากสีชมพูอ่อนไปเป็นสีม่วง ในขณะที่ไอออนของโลหะชนิดอื่นๆ ไม่ส่งผลรบกวนการตรวจวัดแต่อย่างใด ซึ่งจะเห็นได้ว่าชุดตรวจวัดที่พัฒนาขึ้นนี้สามารถตรวจวัดไอออน Hg2+ ที่ละลายอยู่ในน้ำได้ ข้อดีของการเตรียมฟิล์มเพื่อนำมาพัฒนาเป็นชุดตรวจวัดด้วยวิธีนี้คือมีวิธีการเตรียมที่ง่าย ไม่ต้องใช้เครื่องมือหรืออุปกรณ์ที่มีราคาสูง
เอกสารอ้างอิง
Feng, L., Sha, J., Chen, Y., Liu, B., Zhang, H., & Lu, C. (2015). Conjugated polymer and spirolactam rhodamine-B derivative co-functionalized mesoporous silica nanoparticles as the scaffold for the FRET-based ratiometric sensing of mercury (II) ions. Microporous and Mesoporous Materials, 208, 113.
Ghaedi, M., Ahmadi, F., & Shokrollahi, A. (2007). Simultaneous preconcentration and determination of copper, nickel, cobalt and lead ions content by flame atomic absorption spectrometry Journal of Hazardous Materials, 142, 272.
Iyer, D. K., Shaji, A., Singh, S. P., Tripathi, A., Hazra, A., Mandal, S., & Ghosh, P. (2023). A review on rhodamine probes for metal ion recognition with a future on artificial intelligence and machine learning. Coordination Chemistry Reviews, 495(15), 215371.
Leermakers, M., Baeyens, W., Quevauviller, O., & Horvat, M. (2005). Mercury in environmental samples: Speciation, artifacts and validation. TrAC Trends in Analytical Chemistry, 24(5), 383.
Mahajan, R.K., Kaur, I., & Lobana, T.S. (2003). A mercury(II) ion-selective electrode based on neutral salicylaldehyde thiosemicarbazone. Talanta, 59, 101.
Morsi, R. E., Elsawy, M., Manet, I., & Ventura, B. (2020). Cellulose acetate fabrics loaded with rhodamine B hydrazide for optical detection of Cu(II). Molecules, 25, 3751.
O’Meara, J.M., Brjesson, J. , & Chettle, D.R. (2000). Improving the in vivo X-ray fluorescence (XRF) measurement of renal mercury. Applied Radiation and Isotopes, 53, 639.
Rompo, M., Watchasit, S., Imyim, A., & Suksai, C. (2018). Development of nanofibers containing rhodamine B as colorimetric Chemosensor for Cu2+ determination. Burapha Science Journal, 23, 1094.
Sahan, T., Erol, F., & Yilmaz, S. (2018). Mercury(II) adsorption by a novel adsorbent mercapto-modified bentonite using ICP-OES and use of response surface methodology for optimization. Microchmical Journal, 38, 360.
Tuzen, M., Karaman, I., Citak, D., & Soylak, M. (2009). Mercury(II) and methyl mercury determinations in water and fish samples by using solid phase extraction and cold vapour atomic absorption spectrometry combination. Food and Chemical Toxicology, 47, 1648.
Yang, Z. (2024). Voltammetry for quantitative determination of trace mercury ions in water via acetylene black modified carbon paste electrode. Alexandria Engineering Journal, 87, 107.
Yang, Y.-K., Yook, K.-J., & Tae, J. (2005). A Rhodamine-based fluorescent and colorimetric chemodosimeter for the rapid detection of Hg2+ ions in aqueous media. Journal of the American Chemical Society, 127, 46760.
Zhang, Y., Cao, X., Zhen, L., & Wang, X. (2021). A mesoporous silica-based fluorescent chemosensor bearing bis-Schiff base for the sensitive detection of Cu2+ ions. Journal of Solid State Chemistry, 297, 122093.
Zhang , Z., Han, R., Chen, S., Zheng, F., Ma, X., Pan, M., & Wang, S. (2023). Fluorescent and colorimetric dual-mode strategy based on rhodamine 6G hydrazide for qualitative and quantitative detection of Hg2+ in seafoods. Foods, 12, 1085.
Zhu, W., Tang, J., & Huang, L. (2020). Ultra-sensitive electrochemical determination of mercury ions based on the dithizone modified electrode. International journal of electrochemical science, 15 (1), 168-176.
ดาวน์โหลด
เผยแพร่แล้ว
รูปแบบการอ้างอิง
ฉบับ
ประเภทบทความ
สัญญาอนุญาต
ลิขสิทธิ์ (c) 2025 คณะวิทยาศาสตร์ มหาวิทยาลัยบูรพา

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
Burapha Science Journal is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International (CC BY-NC-ND 4.0) licence, unless otherwise stated. Please read our Policies page for more information



