การเสริมฤทธิ์ยับยั้งการเจริญเติบโตและสร้างไบโอฟิล์มของ Glochidonol จาก Glochidion acuminatum กับยาปฏิชีวนะต่อเชื้อแบคทีเรียฉวยโอกาส
คำสำคัญ:
Glochidonol, ตาเสือ, การเสริมฤทธิ์, ยับยั้งการเจริญของแบคทีเรีย, ยับยั้งการสร้างไบโอฟิล์มบทคัดย่อ
วัตถุประสงค์และที่มา : สาร Glochidonol จากตาเสือ (Glochidion acuminatum) มีสรรพคุณ แก้ปวด ลดไข้ และขับปัสสาวะ และมีฤทธิ์ทางชีวภาพต่าง ๆ มากมาย เช่น ฤทธิ์ต้านอาการอักเสบ ฤทธิ์ต้านแบคทีเรีย ต้านอนุมูลอิสระ ต้านมะเร็ง เนื่องจากเชื้อแบคทีเรียฉวยโอกาสที่พบได้บ่อยในโรงพยาบาลมีอุบัติการณ์การดื้อยาสูง ได้แก่ Pseudomonas aeruginosa, Acinetobacter baumannii, Escherichia coli, Klebsiella pneumoniae และ Staphylococcus aureus โดยเฉพาะในผู้ป่วยที่มีภาวะภูมิคุ้มกันบกพร่อง การติดเชื้อจากแบคทีเรียกลุ่มนี้มักมีความรุนแรงและมีแนวโน้มพัฒนาเป็นการติดเชื้อในกระแสเลือด (septicemia) ซึ่งอาจนำไปสู่ภาวะแทรกซ้อนร้ายแรงหรือเสียชีวิต ทำให้การใช้ยาปฏิชีวนะกลุ่มเตราซัยคลิน (tetracyclines) เช่น Oxytetracycline และกลุ่มเพนนิซิลลิน เช่น Ampicillin มีประสิทธิภาพลดลงและใช้ไม่ได้ผล เนื่องจากเชื้อแบคทีเรียฉวยโอกาสมีการพัฒนากลไกการดื้อยาหลายรูปแบบ เช่น การผลิตเอนไซม์ย่อยยา การลดการซึมผ่านของยา และที่สำคัญคือการสร้างไบโอฟิล์ม คือ โครงสร้างเชิงซ้อนของชั้นเมทริกซ์ชีวภาพ (extracellular polymeric substances) ที่แบคทีเรียหลั่งออกมาเพื่อห่อหุ้มตัวเองและเซลล์ใกล้เคียงภายในกลุ่มของเชื้อแบคทีเรียทำให้เชื้ออยู่รอดในสภาวะแวดล้อมที่ไม่เหมาะสม และสามารถเกิดการยึดเกาะแน่นบนพื้นผิวสัมผัส เช่น แผล อุปกรณ์ทางการแพทย์ จึงเป็นปัจจัยสำคัญที่เร่งทำให้เกิดอุบัติการณ์การดื้อยาของแบคทีเรียฉวยโอกาสสูงมาก เนื่องจากยาปฏิชีวนะต้นอนุพันธ์ เช่น ออกซี่เตตราซัยคลิน และ แอมพิซิลลิน มีประสิทธิภาพลดลงจากกลไกการดื้อยาของแบคทีเรียดังกล่าว การพัฒนาการรักษาแบบใหม่จึงมีความจำเป็นอย่างเร่งด่วน หนึ่งในแนวทางที่มีความเป็นไปได้สูง คือการผสมผสานสารออกฤทธิ์ทางชีวภาพจากธรรมชาติเข้ากับยาปฏิชีวนะที่มีอยู่เพื่อเพิ่มประสิทธิภาพในการต้านแบคทีเรีย สารบริสุทธิ์ธรรมชาติคือ Glochidonol เป็นที่น่าสนใจเป็นพิเศษ เนื่องจากอาจช่วยยับยั้งการสร้างไบโอฟิล์ม เพิ่มการซึมผ่านของเยื่อหุ้มเซลล์แบคทีเรีย หรือยับยั้งเอนไซม์ที่เกี่ยวข้องกับการดื้อยาซึ่งส่งผลให้ฤทธิ์ของยาปฏิชีวนะแบบดั้งเดิมมีประสิทธิภาพมากขึ้น ดังนั้นการใช้ Glochidonol ร่วมกับยาปฏิชีวนะอาจจะเป็นทางเลือกใหม่และเป็นการศึกษาครั้งแรกของสารนี้ เพื่อแก้ปัญหาเชื้อแบคทีเรียดื้อยา และลดการปนเปื้อนของเชื้อแบคทีเรียดื้อยาในสิ่งแวดล้อมได้อย่างยั่งยืน งานวิจัยนี้จึงมีวัตถุประสงค์เพื่อศึกษาการเสริมฤทธิ์การยับยั้งการเจริญและสร้างไบโอฟิล์มของ Glochidonol ที่แยกได้จากตาเสือ (Glochidion acuminatum) ต่อเชื้อแบคทีเรียฉวยโอกาส
วิธีดำเนินการวิจัย : งานวิจัยนี้ศึกษาประสิทธิภาพของสาร Glochidonol ในการยับยั้งการเจริญของเชื้อแบคทีเรียฉวยโอกาส โดยการหาค่า Minimal Inhibitory Concentration (MIC) ด้วยวิธี Broth microdilution assay โดยเติม Glochidonol ที่ความเข้มข้นต่าง ๆ ในอาหาร Mueller Hinton Broth และผสมกับเชื้อแบคทีเรีย 1 × 10⁸ CFU/ml จากนั้นบ่มที่ 37°C นาน 18–24 ชั่วโมง และวัดค่าการดูดกลืนแสง 600 นาโนเมตร เพื่อหาค่า MIC และหาค่าการเสริมฤทธิ์ยับยั้งการเจริญของแบคทีเรียด้วยค่า Fractional Inhibitory Concentration Index (FICI) ด้วยวิธี Checkerboard microdilution assay โดยผสม Glochidonol กับยาปฏิชีวนะ จากนั้นนำสารที่ผสมแล้วมาใส่เชื้อแบคทีเรีย 1 × 10⁸ CFU/ml และบ่มตามวิธี MIC แล้วคำนวณค่า FICI เพื่อวิเคราะห์การเสริมฤทธิ์ ส่วนการยับยั้งการสร้างไบโอฟิล์มของเชื้อแบคทีเรีย ทดสอบด้วยวิธีการย้อมสีคริสตัลไวโอเลต (Crystal Violet Assay) โดยเติมสาร Glochidonol หรือยาปฏิชีวนะ จากนั้นบ่ม 24 ชั่วโมง แล้วล้างแบคทีเรียส่วนเกินด้วย Phosphate Buffered Saline จากนั้นย้อมสีไบโอฟิล์มด้วยคริสตัลไวโอเลต 0.1% ตรึงด้วยเมทานอล 100% แล้วละลายตะกอนแบคทีเรียด้วยกรดอะซิติก 33% แล้ววัดการดูดกลืนแสง 600 นาโนเมตร
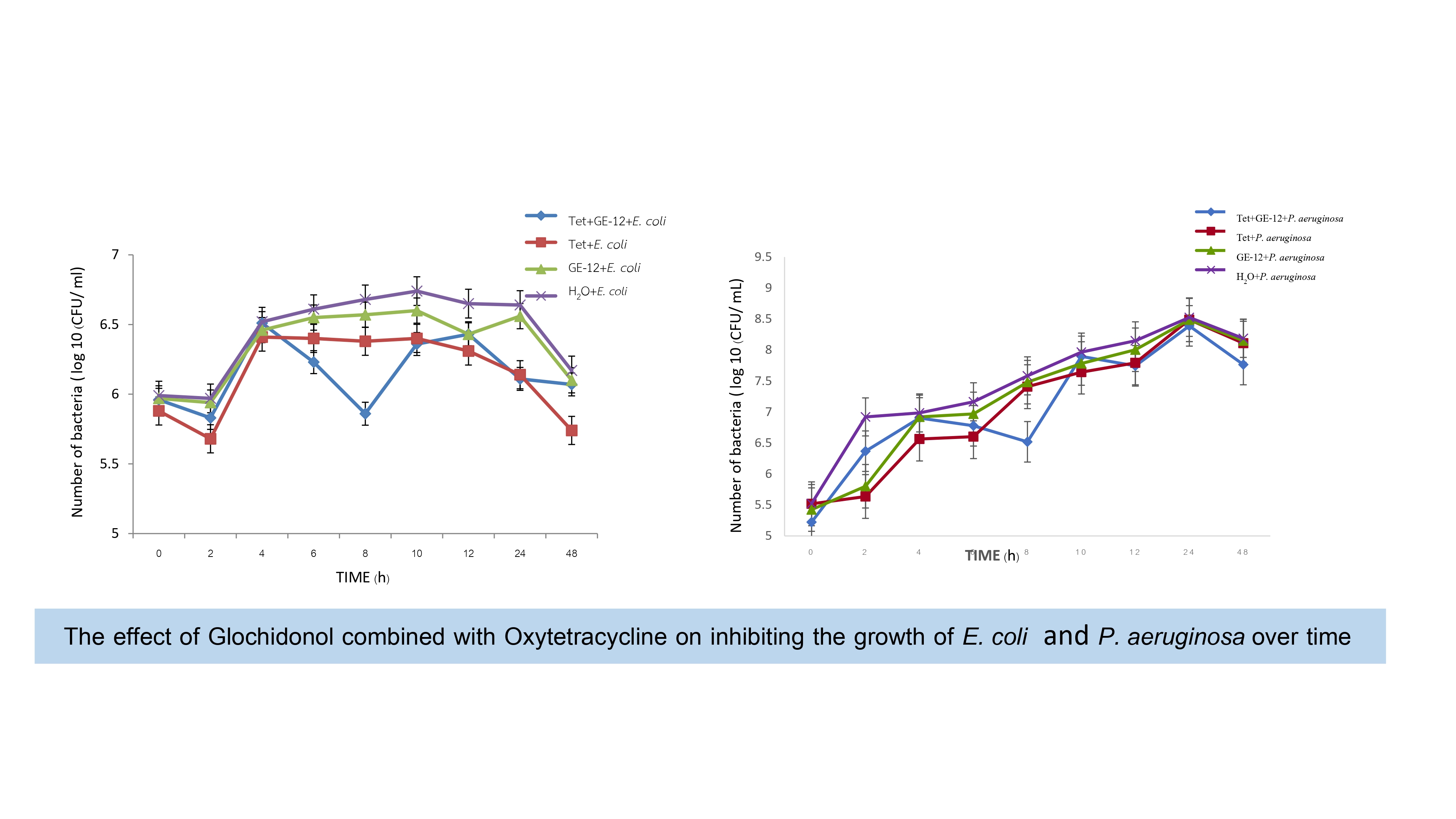
ผลการวิจัย : พบว่าสารบริสุทธิ์ Glochidonol (GE-12) สามารถยับยั้งเชื้อแบคทีเรียฉวยโอกาสได้ทั้งในกลุ่มแบคทีเรียแกรมบวก และกลุ่มแบคทีเรียแกรมลบ GE-12 โดยแสดงฤทธิ์ยับยั้งแบคทีเรียแกรมลบได้ดีที่สุด โดยในกลุ่มเชื้อแบคทีเรียแกรมลบ GE-12 สามารถยับยั้งเชื้อ Acinetobacter baumannii และ Klebsiella pneumoniae มีค่า MIC เท่ากับ 128 ไมโครโมลาร์และเมื่อเปรียบเทียบกับยาปฏิชีวนะทั้งสองชนิดพบว่า GE-12 มีประสิทธิภาพใกล้เคียงกับแอมพิซิลลินและออกซี่เตตราซัยคลิน โดยเฉพาะอย่างยิ่ง GE-12 แสดงการเสริมฤทธิ์กับยาออกซี่เตตราซัยคลินต่อเชื้อ Escherichia coli โดยมีค่า FICI เท่ากับ 0.56 และให้ผลการต้านฤทธิ์กับเชื้อ P. aeruginosa (FICI เท่ากับ 32) แต่ไม่ให้ผลการทดสอบกับเชื้อ A. baumannii การศึกษา time kill assay พบว่า สาร GE-12 สามารถยับยั้งการเจริญของเชื้อ E. coli ได้ดีที่สุดในชั่วโมงที่ 8 เมื่อใช้ ความเข้มข้นสาร GE-12 (1/64 MIC) 16 µM และความเข้มข้นยาออกซี่เตตราซัยคลิน (1/8MIC) 256 µM และยับยั้งเชื้อ Pseudomonas aeruginosa ได้ดีที่สุด เมื่อใช้ความเข้มข้นสารบริสุทธิ์ GE-12 (1/32MIC) 16 µM และความเข้มข้นยาออกซี่เตตราซัยคลิน (1xMIC) 2048 µM นอกจากนี้พบว่า GE-12 ความเข้มข้น 2048 µM สามารถยับยั้งการสร้างไบโอฟิล์มของ A. baumannii, E. coli และ P. aeruginosa ได้ดีที่สุดในช่วงเวลา 2-24 ชั่วโมง โดยประสิทธิภาพการยับยั้งอยู่ในช่วง 25-68%
สรุปผลการวิจัย : Glochidonol ที่แยกได้จาก G. acuminatum สามารถยับยั้งการเจริญของแบคทีเรียแกรมลบได้ดีกว่าแบคทีเรียแกรมบวก และสามารถเสริมฤทธิ์ยับยั้งการเจริญ และยับยั้งการสร้างไบโอฟิล์มของเชื้อแบคทีเรียดื้อยาและไม่ดื้อยาบางสายพันธุ์ ได้แก่ E. coli และ P. aeruginosa
เอกสารอ้างอิง
Alrashidi, A., Jafar, M., Higgins, N., Mulligan, C., Varricchio, C., Moseley, R., Celiksoy, V., Houston, D. M. J., & Heard, C. M. (2021). A time-kill assay study on the synergistic bactericidal activity of pomegranate rind extract and Zn (II) against methicillin-resistant Staphylococcus aureus (MRSA), Staphylococcus epidermidis, Escherichia coli, and Pseudomonas aeruginosa. Biomolecules, 11(12), 1889. doi.org/10.3390/biom11121889
Bai, J., Aswathanarayan, J. B., & Rai, R. V. (2018). Inhibition of biofilm formation and quorum sensing mediated phenotypes by berberine in Pseudomonas aeruginosa and Salmonella typhimurium. RSC Advances, 8(62), 36133–36141. doi.org/10.1039/C8RA06413J
Cheesman, M. J., Ilanko, A., Blonk, B., & Cock, I. E. (2017). Developing new antimicrobial therapies: Are synergistic combinations of plant extracts/compounds with conventional antibiotics the solution? Pharmacognosy Reviews, 11(22), 57–72.
Chung, P. Y., Navaratnam, P., & Chung, L. Y. (2011). Synergistic antimicrobial activity between pentacyclic triterpenoids and antibiotics against Staphylococcus aureus strains. Annals of Clinical Microbiology and Antimicrobials, 10(25), 1–6.
Clinical and Laboratory Standards Institute (CLSI). (2024). Performance Standards for Antimicrobial Susceptibility Testing; 34th Ed. CLSI Document M100-Ed34. Clinical and Laboratory Standards Institute.
El-Wafa, W. M. A., Ahmed, R. H., & Ramadan, M. A. H. (2020). Synergistic effects of pomegranate and rosemary extracts in combination with antibiotics against antibiotic resistance and biofilm formation of Pseudomonas aeruginosa. Brazilian Journal of Microbiology, 51(3), 1079–1092.
Guzzo, F., Scognamiglio, M., Fiorentino, A., Buommino, E., & D’Abrosca, B. (2020). Plant-derived natural products against Pseudomonas aeruginosa and Staphylococcus aureus: Antibiofilm activity and molecular mechanisms. Molecules, 25(21), 5024. doi.org/10.3390/molecules25215024
Jesus, J. A., Lago, J. H. G., Laurenti, M. D., Yamamoto, E. S., & Passero, L. F. D. (2015). Antibacterial activity of ursolic acid and oleanolic acid: An update. Evidence-Based Complementary and Alternative Medicine, 2015, 620472. doi.org/10.1155/2015/620472
Khalequeuzzaman, M., Hasan, S. A., Haque, M., Parul, R., & Alam, R. M. (2023). Evaluation of antioxidant and anti-inflammatory activity of ethanolic extract of Glochidion acuminatum leaves. Asian Journal of Pharmaceutical Research, 13(2), 65–70. doi.org/10.52711/2231-5691.2023.00017
Khwaza, V., & Aderibigbe, B. A. (2024). Potential pharmacological properties of triterpene derivatives of ursolic acid. Molecules, 29(16), 3884. doi.org/10.3390/molecules29163884
Kim, G. S., Park, C. R., Kim, J. E., Kim, H. K., & Kim, B. S. (2022). Anti-biofilm effects of Torilis japonica ethanol extracts against Staphylococcus aureus. Journal of Microbiology and Biotechnology, 32(2), 220–227.
Kongcharoensuntorn, W., & Somnuk, W. (2021). Antibacterial activity of Glochidiol from Glochidion eriocarpum enhanced tetracycline against opportunistic bacteria. Burapha Science Journal, 26(3), 1–10. (in Thai)
Kuete, V., Ngameni, B., Tangmouo, J. G., Bolla, J. M., Alibert-Franco, S., Ngadjui, B. T., & Pagès, J. M. (2010). Efflux pumps are involved in the defense of Gram-negative bacteria against the natural products isobavachalcone and diospyrone. Antimicrobial Agents and Chemotherapy, 54(5), 1749–1752. doi.org/10.1128/AAC.01533-09
Kyriakidis, I., Vasileiou, E., Pana, Z. D., & Tragiannidis, A. (2021). Acinetobacter baumannii antibiotic resistance mechanisms. Pathogens, 10(3), 373. doi.org/10.3390/pathogens10030373
Linh, N. N., Hop, N. Q., Nhung, P. T. T., Dao, P. T. T., Manh, P. T. B., Pham, Y. V., & Son, N. T. (2024). Glochidion species: A review on phytochemistry and pharmacology. Journal of Experimental Pharmacology. doi.org/10.1177/1934578X241276962
Lu, L., Hu, W., Tian, Z., Yuan, D., Yi, G., Zhou, Y.l. (2019). Developing natural products as potential anti-biofilm agents. Chinese Medicine, 14, 11. doi.org/10.1186/s13020-019-0232-2
Nhiem, N. X., Thu, V. K., Kiem, P.V., Minh, C. V., Tai, B. H., Quang, T. H., Cuong, N. X., Yen, P. H., Boo, H. J., Kang, J. I., Kang, H. K., & Kim, Y. H. (2012). Cytotoxic oleane-type triterpene saponins from Glochidion eriocarpum. Archives of Pharmacal Research volume 35(1), 19-26.
Puapairoj, P., Naengchomnong, W., Kijjoa, A., Pinto, M., Nascimento, M. S., Silva, A. M., & Herz, W. (2005). Cytotoxic activity of lupane-type triterpenes from Glochidion sphaerogynum and Glochidion eriocarpum, two of which induce apoptosis. Planta Medica, 71, 208–213.
Ramli, S., Radu, S., Shaari, K., & Rukayadi, Y. (2017). Antibacterial activity of ethanolic extract of Syzygium polyanthum L. (Salam) leaves against foodborne pathogens and application as food sanitizer. BioMed Research International. doi.org/10.1155/2017/9024246
Smitinand, T., Larsen, K. & Santisuk, T. (2007). Flora of Thailand. Vol. 8 part 2. Bangkok: Forest Herbarium, Royal Forest Department.
Song, T., Duperthuy, M., & Wai, S. N. (2016). Sub-optimal treatment of bacterial biofilms. Antibiotics, 5(2), 23. doi.org/10.3390/antibiotics5020023
Song, Y. J., Yu, H. H., Kim, Y. J., Lee, N. K., & Paik, H. D. (2019). Anti-biofilm activity of grapefruit seed extract against Staphylococcus aureus and Escherichia coli. Journal of Microbiology and Biotechnology, 29(8), 1177–1183.
Teixeira, E. H., Andrade, A. L., Pereira, R., Farias, L. P., Monteiro, G. S., & Marinho, M. M. (2023). Antimicrobial, antibiofilm activities and synergic effect of triterpene 3β,6β,16β-trihydroxyilup-20(29)-ene isolated from Combretum leprosum leaves against Staphylococcus strains. Current Microbiology, 80(5), 176. doi.org/10.1007/s00284-023-03284-2
Thang, T. D., Kuo, P. C., Yu, C. S., Shen, Y. C., Hoa, L. T. M., Thanh, T. V., Kuo, Y. H., Yang, M. L., & Wu, T. S. (2011). Chemical constituents of the leaves of Glochidion obliquum and their bioactivity. Archives of Pharmacal Research, 34(3), 383–389. doi.org/10.1007/s12272-011-0305-y
Verderosa, A. D., Totsika, M., & Fairfull-Smith, K. E. (2019). Bacterial biofilm eradication agents: A current review. Frontiers in Chemistry, 7, 824.
Welzen, P.C., & Chayamarit, K. (2007). Flora of Thailand. Vol. 8 part 2. Bangkok : National park wildlife and plant conservation department.
Yang, Y. S., Wei, W., Hu, X. X., Tang, S., Pang, J., You, X. F., Fan, T. Y., Wang, Y. X., & Song, D. Q. (2018). Evolution and antibacterial evaluation of 8-hydroxy-cycloberberine derivatives as a novel family of antibacterial agents against MRSA. Molecules, 24(5), 984.
Zhang, X., Chen, J., & Gao, K. (2012). Chemical constituents from Glochidion wrightii Benth. Biochemical Systematics and Ecology 45, 7-11.
ดาวน์โหลด
เผยแพร่แล้ว
รูปแบบการอ้างอิง
ฉบับ
ประเภทบทความ
สัญญาอนุญาต
ลิขสิทธิ์ (c) 2026 คณะวิทยาศาสตร์ มหาวิทยาลัยบูรพา

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
Burapha Science Journal is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International (CC BY-NC-ND 4.0) licence, unless otherwise stated. Please read our Policies page for more information



