ประสิทธิภาพการย่อยโปรตีนในวัตถุดิบของเอนไซม์จากกุ้งแชบ๊วย Fenneropenaeus merguiensis (De Man, 1888) วัยอ่อน ด้วยวิธีในหลอดทดลอง
คำสำคัญ:
อาหารกุ้งแชบ๊วย , โปรตีนไฮโดรไลเสต , วัตถุดิบอาหารกุ้ง , ทริปซินบทคัดย่อ
วัตถุประสงค์และที่มา : กุ้งแชบ๊วยหรือ Banana Shrimp (Fenneropenaeus merguiensis) เป็นกุ้งทะเลท้องถิ่น ชนิดหลักที่สำคัญทางเศรษฐกิจของประเทศไทย แต่การเพาะเลี้ยงกุ้งแชบ๊วยยังไม่ประสบความสำเร็จเท่าที่ควร เนื่องจากฐานข้อมูลเกี่ยวกับการเพาะเลี้ยงกุ้งแชบ๊วยยังไม่ครอบคลุม รวมทั้งยังไม่มีอาหารสำเร็จรูปสำหรับการเลี้ยงกุ้งแชบ๊วยโดยเฉพาะ ในการศึกษาครั้งนี้เพื่อทดสอบประสิทธิภาพการย่อยโปรตีนของวัตถุดิบอาหารกุ้งด้วยเทคนิค in vitro ด้วยเอนไซม์สกัดของลูกกุ้งแชบ๊วยตั้งแต่วัยอ่อนระยะโปรโตซูเอี้ย 1 (PZ1) จนถึงระยะโพสต์ลาร์วา 60 (PL60) เพื่อสร้างฐานข้อมูลสำหรับการพัฒนาสูตรอาหารและออกแบบสูตรอาหารที่มีประสิทธิภาพ ตรงกับความต้องการสารอาหารเพื่อใช้ในการเจริญเติบโตและพัฒนาการของกุ้งแชบ๊วย และกุ้งแชบ๊วยสามารถใช้สารอาหารจากอาหารสำเร็จรูปได้มากที่สุด โดยเหลือทิ้งน้อยที่สุดเพื่อลดปัญหาสิ่งแวดล้อม รวมทั้งเป็นการลดต้นทุนและสร้างความคุ้มค่าของการผลิตอาหารสัตว์น้ำสำเร็จรูป เพื่อการเพาะเลี้ยงกุ้งแชบ๊วยอย่างประสบความสำเร็จและยั่งยืนในอนาคตอันใกล้
วิธีดำเนินการวิจัย : นำแม่กุ้งแชบ๊วยไข่แก่จากธรรมชาติมาเพาะฟักในโรงเพาะฟักของ ศูนย์วิจัยและพัฒนาอาหารสัตว์น้ำชลบุรี และอนุบาลลูกกุ้งแชบ๊วยตั้งแต่ระยะนอเพลียสจนถึงระยะโพสต์ลาร์วา 60 เก็บตัวอย่างลูกกุ้งแชบ๊วยระยะโปรโตซูเอี้ย 1-3 ไมซิส 1-3 โพสต์ลาร์วา 1, 20, 30, 40, 50 และ 60 เก็บตัวอย่างที่ -80 องศาเซลเซียส จนกระทั่งนำไปวิเคราะห์ จากนั้นนำไปสกัดเอนไซม์โดยใช้ 50 mM Tris-HCl buffer pH 8 สารสกัดเอนไซม์จะถูกเก็บที่ -80 องศาเซลเซียส เพื่อนำไปวิเคราะห์ต่อไป วัตถุดิบที่นำมาทดสอบประสิทธิภาพการย่อยโปรตีน 10 ชนิด ได้แก่ อาร์ทีเมีย กากถั่วเหลือง กากถั่วเหลืองไฮโดรไลเสต หัวกุ้งป่น หมึกป่น ปลาป่น คริล ยีสต์ สไปรูลินา และโปรตีนไฮโดรไลเสตจากเศษปลาทะเล สำหรับประสิทธิภาพการย่อยโปรตีนศึกษาโดยการวัด Trinitrobenzene sulphonic acid (TNBS) ที่ได้จากการย่อยวัตถุดิบอาหารสัตว์กับเอนไซม์สกัดจากลูกกุ้ง เปรียบเทียบกับกราฟมาตรฐานของ DL-alanine คำนวณค่าประสิทธิภาพการย่อยโปรตีนในหน่วย µmol DL-alanine ต่อปริมาณวัตถุดิบ (กรัม) ต่อกิจกรรมจำเพาะของทริปซิน วัดกิจกรรมจำเพาะของทริปซินโดยใช้ 1.25 mM bensoyl-L-arginine-p-nitroanilide (BAPNA) เป็นซับสเตรต (substrate) และใช้กราฟมาตราฐานของ p-Nitroaniline สำหรับปริมาณโปรตีนในเอนไซม์วัดตามวิธีของBradford โดยใช้ bovine serum albumin (BSA) เป็นสารละลายโปรตีนมาตรฐาน จากนั้นนำผลวิเคราะห์ประสิทธิภาพการย่อยโปรตีนในวัตถุดิบมาหาความแปรปรวนแบบทางเดียว (One-way ANOVA) และเปรียบเทียบความแตกต่างทางสถิติด้วยวิธีของ Duncan's New Multiple Range test ที่ระดับความเชื่อมั่น 95% (p<0.05)
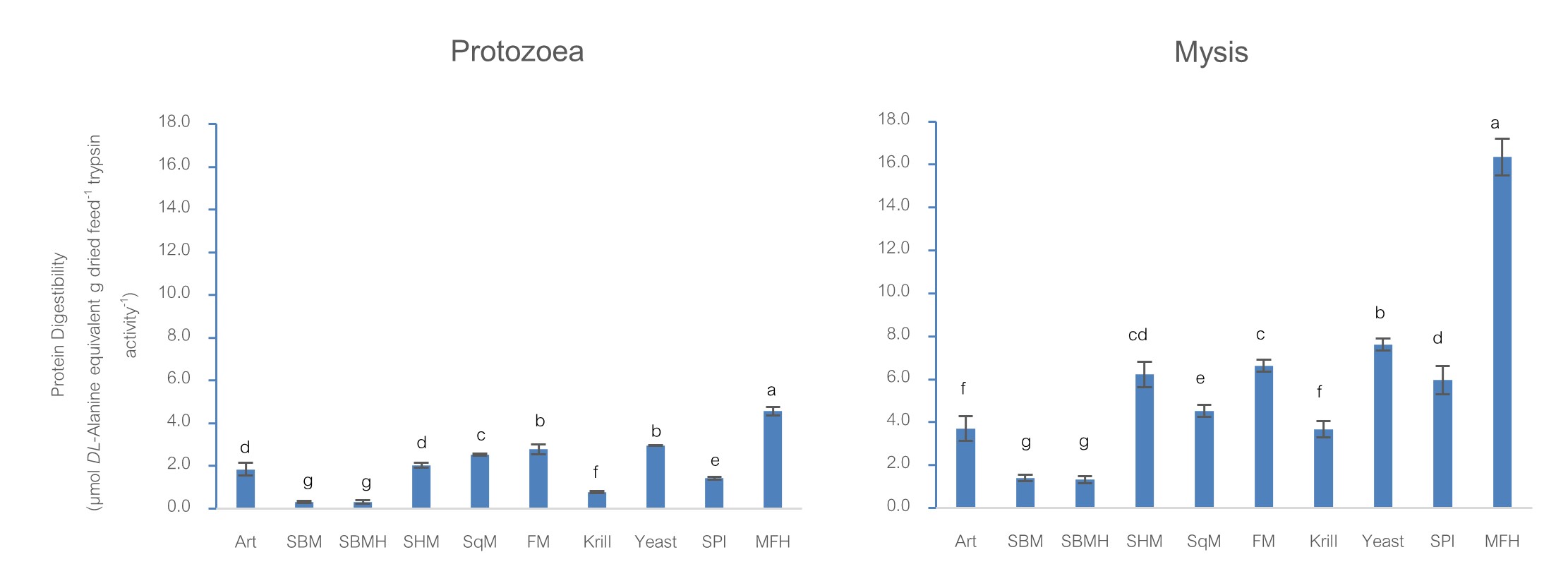
ผลการวิจัย : กุ้งแชบ๊วยวัยอ่อนระยะโปรโตซูเอี้ย 1 ถึง โพสต์ลาร์วา 60 มีประสิทธิภาพการย่อยโปรตีนไฮโดรไลเสตจากเศษปลาทะเลได้ดีที่สุด อย่างมีนัยสำคัญทางสถิติ (p<0.05) อันดับถัดมามีความแตกต่างกันในกุ้งแชบ๊วยแต่ละระยะ ในทางกลับกัน ประสิทธิภาพการย่อย กากถั่วเหลืองไฮโดรไลเสต และกากถั่วเหลือง ของกุ้งแชบ๊วยวัยอ่อนระยะโปรโตซูเอี้ย 1 ถึง โพสต์ลาร์วา 60 มีค่าต่ำสุด เมื่อเปรียบเทียบประสิทธิภาพการย่อยของโปรตีนไฮโดรไลเสตจากเศษปลาทะเลกับปลาป่นซึ่งเป็นวัตถุดิบโปรตีนหลักจากสัตว์ที่ใช้ในการผลิตอาหารกุ้งในปัจจุบัน พบว่า มีประสิทธิภาพสูงกว่า 1.64-2.85 เท่า ในทุกระยะของกุ้งแชบ๊วย (PZ1-PL60) และมีประสิทธิภาพสูงยิ่งขึ้นไปอีกเมื่อเทียบกับ กากถั่วเหลือง ซึ่งเป็นวัตถุดิบโปรตีนหลักอีกชนิดหนึ่งจากพืชที่ใช้ผลิตอาหารกุ้ง พบว่า โปรตีนไฮโดรไลเสตจากเศษปลาทะเลมีประสิทธิภาพการย่อยสูงกว่าถึง 11-22 เท่า และ 45-67 เท่า ในระยะโปรโตซูเอี้ย 1 ถึง โพสต์ลาร์วา 1 และในระยะโพสต์ลาร์วา 20-60 ตามลำดับ สำหรับ กิจกรรมจำเพาะของทริปซินในลูกกุ้งแชบ๊วยมีค่าสูงสุดในระยะโปรโตซูเอี้ย 2 และลดลงเล็กน้อยในระยะโปรโตซูเอี้ย 3 แต่โดยรวมแล้วกิจกรรมจำเพาะทริปซินในระยะโปรโตซูเอี้ยมีค่าสูงกว่าระยะไมซิสและระยะต่อๆ ไป โดยเริ่มลดลงเมื่อลูกกุ้งพัฒนาเข้าสู่ระยะไมซิส 1 และลดลงอย่างต่อเนื่องในระยะ ไมซิส 2 และ ไมซิส 3 เมื่อลูกกุ้งเปลี่ยนเข้าสู่ระยะโพสต์ลาร์วา 1 ค่ากิจกรรมจำเพาะของทริปซินเพิ่มขึ้นอีกครั้ง เนื่องจากค่ากิจกรรมจำเพาะของเอนไซม์ทริปซินคิดเป็นค่าต่อหน่วยโปรตีน ดังนั้นเมื่อลูกกุ้งมีขนาดใหญ่ขึ้นก็จะมีค่ากิจกรรมทริปซินน้อยลงจากระยะโพสต์ลาร์วา 20 ถึงโพสต์ลาร์วา 60
สรุปผลการวิจัย : กุ้งแชบ๊วยในระยะโปรโตซูเอี้ย 1 ถึงโพสต์ลาร์วา 60 มีประสิทธิภาพในการย่อยโปรตีนไฮโดรไลเสตจากเศษปลาทะเลได้ดีที่สุด อันดับถัดมามีความแตกต่างกันในกุ้งแชบ๊วยแต่ละระยะ โดยที่ ยีสต์ ปลาป่น หมึกป่น และสไปรูลิน่า จัดเป็นวัตถุดิบโปรตีนที่ย่อยได้ง่าย ตามมาด้วย หัวกุ้งป่น คริล และ อาร์ทีเมีย ในขณะที่ประสิทธิภาพการย่อย กากถั่วเหลืองไฮโดรไลเสต และกากถั่วเหลือง ของกุ้งแชบ๊วยวัยอ่อนระยะโปรโตซูเอี้ย 1 ถึง โพสต์ลาร์วา 60 มีค่าต่ำสุด ส่วนโปรตีนไฮโดรไลเสตจากเศษปลาทะเลมีศักยภาพที่จะนำมาใช้เป็นวัตถุดิบอาหารสัตว์ทางเลือก โดยเฉพาะการทดแทนปลาป่นในระดับที่เหมาะสม เป็นการใช้เศษของเหลือให้มีคุณค่า ลดของเสีย และนำมาเพิ่มคุณค่าทางอาหารได้ สำหรับระดับกิจกรรมจำเพาะของเอนไซม์ทริปซินในกุ้งแชบ๊วยวัยอ่อน แสดงให้เห็นถึงการกินอาหารที่เหมาะสมกับกุ้งแชบ๊วยวัยอ่อนในแต่ละระยะได้แก่ ระยะโปรโตซูเอี้ยกินแพลงก์ตอนพืช (herbivores) ระยะไมซิสกินทั้งแพลงก์ตอนพืชและสัตว์ (omnivores) และระยะโพสต์ลาร์วากินแพลงก์ตอนสัตว์ (carnivores) ตามลำดับ จากผลของการศึกษาประสิทธิภาพการย่อยโปรตีนในวัตถุดิบอาหารสัตว์และกิจกรรมจำเพาะของทริปซินในครั้งนี้สามารถใช้เป็นแนวทางในการสร้างสูตรอาหารสำเร็จรูปที่มีประสิทธิภาพสูงสำหรับการเพาะเลี้ยงกุ้งแชบ๊วยในอนาคต
เอกสารอ้างอิง
Bradford, M.M. (1976). A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein dye binding. Analytical Biochemistry, 72, 248-254. doi.org/10.1016/0003-2697(76)90527-3.
Buathong, T., Foowut, J., & Krongpong, L. (2019). Potential of protein hydrolysate production from marine fish waste with 3 selected bacteria strains. In Proceeding Annual Conference on Fisheries 2019. (pp. 55-66.) Bangkok: Department of Fisheries. (in Thai)
Chaklader, M.R., Howieson, J., Foysal, M.J., Hanif, M.A., Abdel-Latif, H.M.R., & Fotedar, R. (2023). Fish waste to sustainable additives: Fish protein hydrolysates alleviate intestinal dysbiosis and muscle atrophy induced by poultry by-product meal in Lates calcarifer juvenile. Frontiers in Nutrition, 10, 1145068. doi.org/10.3389/fnut.2023.1145068.
Chungyampin, S., & Phumchuai, C. (2000). Culture of banana shrimp, Penaeus merguiensis De Man, for broodstock in earthen ponds. No.24/2000. Trang Coastal Aquaculture Station, Coastal Aquaculture Division, Department of Fisheries,18 p. (in Thai)
Department of Fisheries. (2024a). FISHERIES STATISTICS OF THAILAND 2023. No. 11/2024. Fishery Statistics Group, Fisheries Development Policy and Planning Division, Department of Fisheries, Thailand, 93 p. (in Thai)
Department of Fisheries. (2024b). STATISTICS OF MARINE SHRIMP CULTURE 2023. No. 10/2024. Fishery Statistics Group, Fisheries Development Policy and Planning Division, Department of Fisheries, Thailand, 44 p. (in Thai)
Domínguez, H., Iñarra, B., Labidi, J., & Bald, C. (2024). Fish viscera hydrolysates and their use as biostimulants for plants as an approach towards a Circular Economy in Europe: A Review. Sustainability, 16(20), 8779. doi.org/10.3390/su16208779.
Ezquerra, J.M., García Carreño, F.L., Civera, R., & Haard, N. (1997). pH-stat method to predict protein digestibility in white shrimp (Penaeus vannamei). Aquaculture, 157, 251-262. doi.org/10.1016/S0044-8486(97)00058-6.
Fan, Z., Wu, D., Li, C. Zhou, M., Wang, L., Zhang, H., Li, J., Rong, X., Miao, L., Zhao, D., & Wang, J. (2024). Application of fish protein hydrolysates in common carp (Cyprinus carpio) diets for fish meal sparing: Evidence from growth, intestinal health and microflora composition. Aquaculture Reports, 36, 102160. doi.org/10.1016/j.aqrep.2024.102160.
Fernández Gimenez, A. V., Díaz, A. C., Velurtas, S. M., & Fenucci, J. L. (2009). In vivo and in vitro protein digestibility of formulated feeds for Artemesia longinaris (Crustacea, Penaeidae). Brazilian Archives of Biology and Technology, 52(6), 1379-1386. doi.org/10.1590/S1516-89132009000600009.
Iadnoi, Y. Ingkhakul, A., Kovitwathi, U., & Thankitjanukit, S. (2007). Characterization and in vitro digestibility of digestive enzyme in giant black tiger shrimp Penaeus monodon, white shrimp Penaeus vannamei and giant fresh water prawn Macrobrachium rosenbergii. Journal of Fisheries Technology Research, 1(2), 248-260. (in Thai)
Jones, D.A., Kumlu, M., Le Vay, L., & Fletcher, D.J. (1997). The digestive physiology of herbivorous, omnivorous and carnivorous crustacean larvae: a review. Aquaculture, 155(1–4), 285-295.doi.org/10.1016/S0044-8486(97)00129-4.
Kanazawa, A. (1989). Microparticulate feeds for Penaeid larvae. Advances in tropical aquaculture,pp.395-404.
Khosravi, S., Bui, H.T.D., Rahimnejad, S., Herault, M., Fournier, V., Jeong, J.B., & Lee, K.-J. (2015).Effect of dietary hydrolysate supplementation on growth performance, non-specific immune response and disease resistance of olive flounder (Paralichthys olivaceus) challenged with Edwardsiella tarda. Aquaculture nutrition, 21(3), 321-331. doi.org/10.1111/anu.12157.
Klompong, V., Benjakul, S., Kantachote, D., & Shahidi, F. (2007). Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally (Selariodes leptolepis) as influenced by the degree of hydrolysis and enzyme type. Food chemistry, 102(4), 1317-1327.doi.org/10.1016/j.foodchem.2006.07.016.
Kolkovski, S., & Tandler, A. (2000). The use of squid protein hydrolysate as a protein source in microdiets for gilthead seabream Sparus aurata larvae. Aquaculture Nutrition, 6(1), 11-15.doi.org/10.1046/j.1365-2095.2000.00125.x.
Kumlu, M. (1995). Physiology of decapod crustacean larvae with special reference to diet. (Ph.D. Thesis). School of Ocean Science, University of Wales, Bangor, UK.
Lee, P.G., & Lawrence, A.L. (1997). Digestibility. Advances in World Aquaculture, 6, 194-260.
Lemos, D., Garcia-Carreño, F.L., Hernandez, P., & Navarrete del Toro, A. (2002). Ontogenetic variation in digestive proteinase activity, RNA and DNA content of larval and post larval white shrimp Litopenaeus schmitti. Aquaculture, 214, 363-380. doi.org/10.1016/S0044-8486(02)00253-3.
Lemos, D., Hernandez-Cortes, M. P., Navarrete, A., García-Carreño, F., & Phan, V. N. (1999). Ontogenetic variation in digestive proteinase activity of larvae and postlarvae of the pink shrimp Farfantepenaeus paulensis (Crustacea: Decapoda: Penaeidae). Marine Biology, 135(4), 653–662.doi.org/10.1007/S002270050666.
Le Vay, L., Rodríguez, A., Kamarudin, M.S., & Jones, D.A. (1993). Influence of live and artificial diets on tissue composition and trypsin activity in Penaeus japonicus larvae. Aquaculture, 118(3-4), 287-297. doi.org/10.1016/0044-8486(93)90463-9.
Maytorena-Verdugo, C. I., Córdova-Murueta, J. H., & García-Carreño, F. (2017). Peptidase compensation in the digestive system of white leg shrimp Penaeus vannamei against dietary Kunitz‐type soybean trypsin inhibitor. Aquaculture Nutrition, 23(5), 1095–1103. doi.org/10.1111/ANU.12477.
Nguyen, H. T. M., Perez-Galvez, R. , & Berge, J. P. (2012). Effect of diets containing tuna head hydrolysate on the survival and growth of shrimp Penaeus vannamei. Aquaculture, 324-325, 127-134. doi.org/10.1016/j.aquaculture.2011.11.014.
Nguyen, M.C., Fotedar, R., & Giridharan, B. (2023). The effects of fish protein hydrolysate as supplementation on growth performance, feed utilization and immunological response in fish: A review. MATEC web of conferences. doi.org/10.1051/matecconf/202337701020.
Okedigba, A. O., Gómez Rosso, L., Yu, D., Shang, C., Huang, H., Zhang, B., & Capelluto, D. G. S. (2023). Comparative binding affinity analysis of soybean meal Bowman-Birk and Kunitz trypsin inhibitors in interactions with animal serine proteases. ACS Food Science & Technology, 3(8), 1344–1352. doi.org/10.1021/acsfoodscitech.3c00158.
Ovissipour, R., Abedian Kenari, A., Nazari, R., Motamedzadegan, A., & Rasco, B. (2014). Tuna viscera protein hydrolysate: nutritive and disease resistance properties for Persian sturgeon (Acipenser persicus L.) larvae. Aquaculture research, 45(4), 591-601. doi.org/10.1111/j.1365-2109.2012.03257.x.
Pongmaneerat, J., Chainark, P., & Chindamaikul, T. (2003). Protein digestibility of some feed ingredients in diets black tiger shrimp (Penaeus monodon Fabricius) and banana prawn (Penaeus merguiensis). No.15/2003. Phangnga Coastal Fisheries Rearch and Development Center, Department of Fisheries, 22 p. (in Thai)
Puello-Cruz, A. C., Sangha, R. S., Jones, D. A., & Le Vay, L. (2002). Trypsin enzyme activity during larval development of Litopenaeus vannamei (Boone) fed on live feeds. Aquaculture Research, 33(5), 333-338. doi.org/10.1046/j.1365-2109.2002.00676.x.
Rungruangsak-Torrissen, K., Rustad, A., Sunde, J., Eiane, S.A., Jensen, H.B., Opstvedt, J., Nygard, E., Samuelsen, T.A., Mundheim, H., Luzzana, U., & Venturini, G. (2002). In vitro digestibility based on fish crude enzyme extract for prediction of feed quality in growth trials. Journal of the Science of Food and Agriculture, 82, 644-654. doi.org/10.1002/jsfa.1089.
Rungruangsak-Torrissen, K., Moss, R., Andresen, L.H., & Waagbø, R. (2006). Different expressions of trypsin and chymotrypsin in relation to growth in Atlantic salmon (Salmo salar L.). Fish Physiology and Biochemistry, 32, 7–23. doi.org/10.1007/s10695-005-0630-5.
Sanchez-Paz, A., Garcia-Carreno, L.F., Muhlia-Almazan, A., Hernandez-Saavedra, N., & Yepiz-Plascencia, G. (2003). Differential expression of trypsin mRNA in the white shrimp Penaeus vannamei midgut gland under starvation conditions. Journal of Experimental Marine Biology and Ecology, 292, 1-7. doi.org/10.1016/S0022-0981(03)00142-4.
Sandbakken, I.S., Johansen L., Zhang, Y., Ringø, E., Røsbak, R., Yakovlev, I., Five, K., & Olsen, R.E. (2024). Replacing fishmeal with salmon hydrolysate reduces the expression of intestinal inflammatory markers and modulates the gut microbiota in Atlantic salmon (Salmo salar). Frontiers in Marine Science, 11, 1376516. doi.org/10.3389/fmars.2024.1376516.
Siddik, S., Howieson, J., Partridge, G., Fotedar, R., & Gholipourkanani, H. (2018). Dietary tuna hydrolysate modulates growth performance, immune response, intestinal morphology and resistance to Streptococcus iniae in juvenile barramundi, Lates calcarifer. Scientific Reports, 8(1), 15942-13. doi.org/10.1038/s41598-018-34182-4.
Tacon, A.G.J., & Metian, M. (2008). Global overview on the use of fish meal and fish oil in industrially compounded aquafeeds: Trends and future prospects. Aquaculture, 285, 146-158. doi.org/10.1016/j.aquaculture.2008.08.015.
Thongprajukaew, K., & Kovitvadhi, U. (2012). Enzymes and Food Development for Aquaculture. The Journal of King Mongkut’s University of Technology North Bangkok, 22(3), 710-720. (in Thai)
Turkmen, G., & Baysal, S. H. (2007). Trypsin Enzyme Activity during Larval Development of Penaeus semisulcatus De Haan, 1844, Fed on Live Feeds. Crustaceana, 80(2), 225–234. Retrieved from http://www.jstor.org/stable/20107798.
Wu, H. C., Chen, H. M., & Shiau, C. Y. (2003). Free amino acid and peptide as related to antioxidant properties in protein hydrolysates of mackerel (Scomber austriasicus). Food Research International, 36, 949-957. doi.org/10.1016/S0963-9969(03)00104-2.
Xu, H., Mu, Y., Zhang, Y., Li, J., Liang, M., Zheng, K., & Wei, Y. (2016). Graded levels of fish protein hydrolysate in high plant diets for turbot (Scophthalmus maximus): effects on growth performance and lipid accumulation. Aquaculture, 454, 140-147. doi.org/10.1016/j.aquaculture.2015.12.006.
Zheng, K., Xu, T., Qian, C., Liang, M., & Wang, X. (2014). Effect of low molecular weight fish protein hydrolysate on growth performance and IGF-I expression in Japanese flounder (Paralichthys olivaceus) fed high plant protein diets. Aquaculture nutrition, 20(4), 372-380. doi.org/10.1111/anu.12090.
ดาวน์โหลด
เผยแพร่แล้ว
รูปแบบการอ้างอิง
ฉบับ
ประเภทบทความ
สัญญาอนุญาต
ลิขสิทธิ์ (c) 2025 คณะวิทยาศาสตร์ มหาวิทยาลัยบูรพา

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
Burapha Science Journal is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International (CC BY-NC-ND 4.0) licence, unless otherwise stated. Please read our Policies page for more information



