การคัดเลือกแบคทีเรียโพรไบโอติกที่สามารถผลิตสารกาบ้า เพื่อประยุกต์ใช้เป็นอาหารเสริมในไก่ไข่
คำสำคัญ:
โพรไบโอติก , สารกาบ้า , ไก่ไข่ , ความเครียดอันเนื่องจากความร้อน , อาหารเสริมสัตว์บทคัดย่อ
วัตถุประสงค์และที่มา : ปัญหาหลักที่กระทบต่อการเลี้ยงไก่ไข่ในประเทศไทยโดยเฉพาะอย่างยิ่งผลกระทบต่อการเจริญเติบโตและประสิทธิภาพการผลิตไข่คือโรคระบาดและความเครียดอันเนื่องมาจากความร้อน การเสริมแบคทีเรียโพรไบโอติกที่มีชีวิตในอาหารไก่ได้รับการยอมรับอย่างกว้างขวางว่ามีประสิทธิภาพลดการติดเชื้อ และช่วยส่งเสริม สุขภาพไก่ทดแทนการใช้ยาปฏิชีวนะ ที่ปัจจุบันถูกสั่งห้ามใช้อย่างเข้มงวดในหลายประเทศและรวมถึงประเทศไทย อีกทั้งกรดแกมม่า – อะมิโนบิวทิริก (สารกาบ้า) มีบทบาทช่วยลดผลกระทบจากความเครียดอันเนื่องมาจากความร้อนที่มีต่อการเจริญและประสิทธิภาพการผลิตไข่ไก่ได้ ดังนั้นการค้นพบสายพันธุ์แบคทีเรียโพรไบโอติกที่สามารถผลิตสารกาบ้าได้ควบคู่กันและมีความจำเพาะสูงต่อทางเดินอาหารของไก่นับได้ว่าเป็นกลยุทธที่มีศักยภาพเพื่อนำมาใช้ในการเลี้ยงไก่ไข่และการผลิตไข่ งานวิจัยนี้มีวัตถุประสงค์เพื่อคัดเลือกแบคทีเรียโพรไบโอติกที่สามารถผลิตสารกาบ้าได้โดยคัดแยกมาจากทางเดินอาหารของไก่ไข่เพื่อเป้าหมายในการลดผลกระทบจากปัญหาดังกล่าว และเพื่อทดสอบการรอดชีวิตของโพรไบโอติกหลังการขึ้นรูปเป็นผงผลิตภัณฑ์
วิธีดำเนินการวิจัย : คัดแยกแบคทีเรียกรดแลคติกจากทวารร่วมของไก่ไข่โดยเพาะเลี้ยงบนอาหารแข็งสูตร de Man Rogosa and Sharpe (MRS) จากนั้นทดสอบคุณสมบัติโพรไบโอติกเบื้องต้นของแบคทีเรียทุกไอโซเลตดังกล่าวในระดับ in vitro ได้แก่ กิจกรรมย่อยเม็ดเลือดแดงในอาหารแข็งสูตร sheep blood (แอลฟ่า เบต้า และแกมม่า - ฮีโมไลซีส) ความสามารถในการเจริญภายใต้สภาวะกรด (pH 2.0 2.5 3.0 และ 3.5) และน้ำดี (เข้มข้นร้อยละ 0.3 และ 1.0 (w/v)) คุณสมบัติความไม่ชอบน้ำของพื้นผิวเซลล์ที่ประเมินจากความสามารถของเซลล์ในการจับกันเองเมื่อทดสอบด้วยการเติมสารโทลูอีน ความไวต่อยาปฏิชีวนะจำนวน 13 ชนิดโดยแปลผลเทียบกับมาตรฐานของ the Clinical and Laboratory Standards Institute (CLSI) และฤทธิ์ต้านแบคทีเรียก่อโรคทางเดินอาหารบางชนิด ได้แก่ Escherichia coli, Salmonella Typhi และ Staphylococcus aureus ด้วยเทคนิค spot on lawn จากนั้นทดสอบความสามารถการผลิตสารกาบ้า ในอาหารเหลวสูตร MRS ที่เสริมด้วยสารโมโนโซเดียมกลูตาเมตความเข้มข้นร้อยละ 0.5 (w/v) วิเคราะห์สารกาบ้า เชิงปริมาณและเชิงคุณภาพด้วยเทคนิคทางสเปกโทรโฟโตเมทรีและโครมาโทกราฟีผิวบาง ตามลำดับ ระบุชนิดของ ไอโซเลตที่คัดเลือกด้วยการวิเคราะห์ลำดับนิวคลิโอไทด์ของยีน 16S rRNA เทียบกับฐานข้อมูล GenBank และท้ายที่สุด ทำการขึ้นรูปเป็นผงโพรไบโอติกโดยผสมกับรำข้าวแล้วทำแห้งด้วยเทคนิคการทำแห้งแบบเยือกแข็ง และทดสอบการรอดชีวิตเมื่อเก็บรักษาผงโพรไบโอติกที่อุณหภูมิ 4 องศาเซลเซียสและอุณหภูมิห้องเป็นเวลา 12 สัปดาห์ในถุงอลูมิเนียมฟอยล์ปิดสนิท
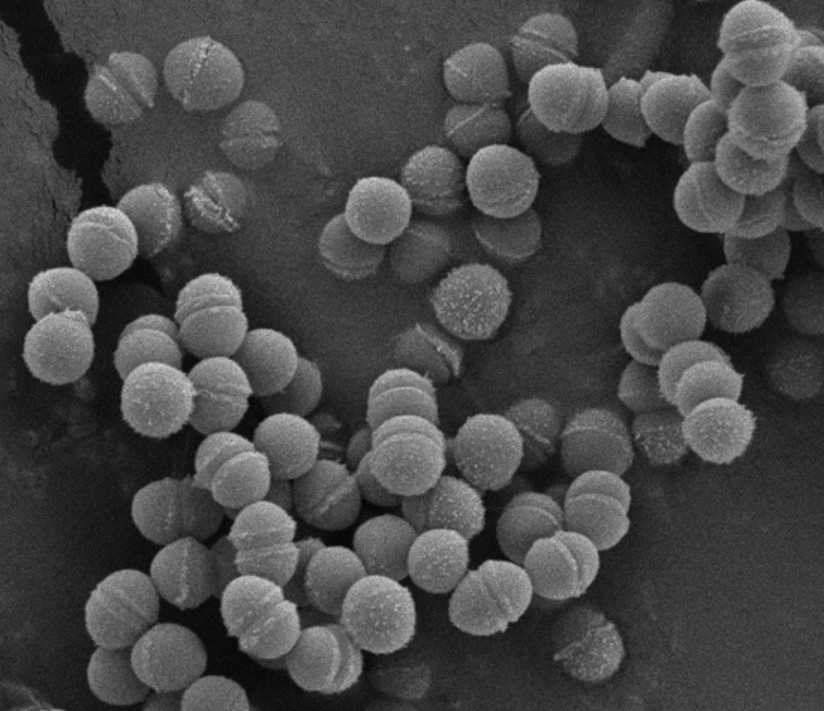
ผลการวิจัย : ผลการศึกษาพบว่าสามารถคัดแยกแบคทีเรียแกรมบวก ไม่ผลิตเอนไซม์คะตะเลส และผลิตกรดจำนวน 42 ไอโซเลตจากตัวอย่างมูลที่เก็บจากรูทวารร่วมของไก่ไข่ แบ่งเป็นแบคทีเรียรูปร่างกลมและท่อนจำนวน 5 และ 37 ไอโซเลต ตามลำดับ ภายหลังการทดสอบคุณสมบัติโพรไบโอติกเบื้องต้นพบว่าไอโซเลต LH5 ซึ่งเซลล์มีรูปร่างกลม เรียงตัวเป็นคู่และสายสั้นมีศักยภาพเป็นโพรไบโอติกได้ดีที่สุดเมื่อทดสอบภายใต้สภาวะจำลองของทางเดินอาหารไก่ โดยสามารถเจริญได้ที่ pH 2.0 – 3.5 และมีน้ำดีความเข้มข้นสูงร้อยละ 1.0 (w/v) พื้นผิวเซลล์แสดงคุณสมบัติความไม่ชอบน้ำระดับปานกลางโดยมีค่า %CSH เท่ากับ 57 ไวต่อยาปฏิชีวนะชนิด penicillin, ampicillin, vancomycin, cefoxitin, chloramphenicol, clindamycin, ceftriaxone, ciprofloxacin, cephalothin และ rifampicin แต่ต้านยาปฏิชีวนะชนิด gentamycin, erythromycin และ nalidixic acid ไอโซเลต LH5 สามารถยับยั้งการเจริญของแบคทีเรียก่อโรคชนิด S. Typhi ที่เป็นแบคทีเรียก่อโรคอันตรายสาเหตุของการระบาดของโรค Salmonellosis และยับยั้ง S. aureus ด้วย ไอโซเลตนี้ไม่แสดงคุณสมบัติการสลายเม็ดเลือดแดงในอาหารแข็ง sheep blood (แกมม่า - ฮีโมไลซีส) และได้รับการระบุชนิดเป็น Enterococcus faecium ด้วยค่า %similarity ร้อยละ 100 E. faecium LH5 ยังสามารถผลิตสารกาบ้าได้ในปริมาณ 09.05 mg/L ซึ่งสามารถตรวจพบได้อย่างชัดเจนบนแผ่นอลูมิเนียมที่เคลือบด้วยซิลิกาเจล นอกจากนี้ เซลล์ของ E. faecium LH5 ในผงโพรไบโอติกมีการรอดชีวิตสูงถึงร้อยละ 95.39 + 0.07 และ 94.15 + 0.19 หลังการเก็บรักษา 12 สัปดาห์ ที่อุณหภูมิ 4 องศาเซลเซียสและอุณหภูมิห้อง (ประมาณ 30 องศาเซลเซียส) ตามลำดับ และไม่แตกต่างกันอย่างมีนัยสำคัญ (p>0.05) ระหว่างอุณหภูมิทั้งสองระดับในแต่ละสัปดาห์
สรุปผลการวิจัย : E. faecium LH5 เป็นแบคทีเรียที่มีศักยภาพเป็นโพรไบโอติกและสามารถผลิตสารกาบ้าได้ เซลล์มีความเสถียรต่อกระบวนการขึ้นรูปเป็นผงแห้งและการเก็บรักษาไว้ที่อุณหภูมิห้อง ดังนั้นจึงมีแนวโน้มใช้ประโยชน์เป็นสารเสริมชีวนะในอาหารไก่ไข่ต่อไป อย่างไรก็ตาม จำเป็นต้องศึกษาผลของการเสริม E. faecium LH5 ที่มีต่อสมรรถนะการเจริญและประสิทธิภาพการผลิตไข่ไก่ทั้งภายใต้สภาวะความเครียดอันเนื่องจากความร้อนและภาวะการติดเชื้อก่อโรคก่อนการประยุกต์ใช้จริงในลักษณะของอาหารเสริมสัตว์
เอกสารอ้างอิง
Abdallah, F. B., Lagha, R., Khaled, S., Kallel, H., & Gharbi, J. (2014). Detection of cell surface hydrophobicity, biofilm and fimbirae genes in Salmonella isolated from Tunisian clinical and poultry meat. Iranian Journal of Public Health, 43(4), 423.
Ben-Miled, H., Benoit-Biancamano, M.-O., Ben-Mahrez, K., & Réjiba, S. (2023). Alpha-amylase and alphaglucosidase inhibitory properties, beta-galactosidase activity, and probiotic potential of lactic acid bacteria and bifidobacteria from Apis mellifera intermissa and its products. World Journal of Microbiology and Biotechnology, 39(8), 205.
Bouchard, D. S., Seridan, B., Saraoui, T., Rault, L., Germon, P., Gonzalez-Moreno, C., Nader-Macias, F. M., Baud, D., François, P., & Chuat, V. (2015). Lactic acid bacteria isolated from bovine mammary microbiota: potential allies against bovine mastitis. PloS one, 10(12), e0144831.
Bs, S., Thankappan, B., Mahendran, R., Muthusamy, G., Femil Selta, D. R., & Angayarkanni, J. (2021). Evaluation of GABA production and probiotic activities of Enterococcus faecium BS5. Probiotics and Antimicrobial Proteins, 13, 993-1004.
Carvajal, E., Contreras, S., Díaz, W., Martinez-Bello, D., McCown, M., Ardila, Y., & Vásquez, M. C. (2023). Enterococcus isolated from poultry intestine for potential probiotic use. Veterinary World, 16(8), 1605.
Casertano, M., Fryganas, C., Valentino, V., Troise, A.D., Vitaglione, P., Fogliano, V., & Ercolini, D. (2024). Gut production of GABA by a probiotic formula: an in vitro study. Beneficial Microbes, 15(1), 67-81.
Chantanawilas, P., Pahumunto, N., & Teanpaisan, R. (2024). Aggregation and adhesion ability of various probiotic strains and Candida species: an in vitro study. Journal of Dental Sciences,19(4), 2163-2171.
Chen, Z., Niu, C., Wei, L., Huang, Z., & Ran, S. (2024). Genome-wide analysis of acid tolerance genes of Enterococcus faecalis with RNA-seq and Tn-seq. BMC Genomics, 25, 261.
Cruz, A. G., Antunes, A. E., Sousa, A. L. O., Faria, J. A., & Saad, S. M. (2009). Ice-cream as a probiotic food carrier. Food Research International, 42(9), 1233-1239.
Devi, P. B., Rajapuram, D. R., Jayamanohar, J., Verma, M., Kavitake, D., Avany, B. A. M., Rani, P. U., Ravi, R., & Shetty, P. H. (2023). Gamma-aminobutyric acid (GABA) production by potential probiotic strains of indigenous fermented foods origin and RSM based production optimization. LWT, 176, 114511.
Diana, M., Quílez, J., & Rafecas, M. (2014). Gamma-aminobutyric acid as a bioactive compound in foods: a review. Journal of Functional Foods, 10, 407-420.
Elkomy, A., Zahra, A.E., Belih, S., Shaheen, Y., & Aboubakr, M. (2020). Effect of drinking water supplemented with gamma-aminobutyric acid (GABA) on laying performance and egg quality parameters in laying hens. International Journal of Advanced Research, 8, 312-317
Elhussiny, M. Z., Tran, P. V., Pham, C. V., Nguyen, L. T., Haraguchi, S., Gilbert, E. R., Cline, M. A., Bungo, T., Furuse, M., & Chowdhury, V. S. (2021). Central GABAA receptor mediates taurine-induced hypothermia and possibly reduces food intake in thermo-neutral chicks and regulates plasma metabolites in heat-exposed chicks. Journal of Thermal Biology, 98, 102905.
Frank, J.A., Reich, C.I., Sharma, S., Weisbaum, J.S., Wilson, B.A., & Olsen, G.J. (2008). Critical evaluation of two primers commonly used for amplification of bacterial 16S rRNA genes. Applied and Environmental Microbiology, 74, 2461–2470.
Gibson, G.R., Probert, H.M., Loo, J.V., Rastall, R.A., & Roberfroid, M.B. (2004). Dietary modulation of the human colonic microbiota: updating the concept of prebiotics. Nutrition Research Reviews, 17, 259–275.
Gil, M. G., Gomez-Raya, L., Torres, O., Cigarroa-Vazquez, F. A., Davila, S. G., & Rauw, W. M. (2023). Heterophil/lymphocyte response of local Spanish breeds of laying hens to cold stress, heat stress, and water restriction. Journal of Thermal Biology, 113, 103542.
Gul, K., Yousuf, B., Singh, A., Singh, P., & Wani, A. A. (2015). Rice bran: Nutritional values and its emerging potential for development of functional food - A review. Bioactive Carbohydrates and Dietary Fibre, 6(1), 24-30.
Gunn, J. S. (2000). Mechanisms of bacterial resistance and response to bile. Microbes and Infection, 2(8), 907-913.
Han, J., Zhao, X., Zhao, X., Wang, Q., Li, P., & Gu, Q. (2023). Microbial-derived -aminobutyric acid: synthesis, purification, physiological function, and applications. Journal of Agricultural and Food Chemistry, 71(41), 14931-14946.
Hervo, F., Létourneau-Montminy, M. P., Méda, B., & Narcy, A. (2024). Effect of limestone particle size and microbial phytase on phosphorus and calcium digestion kinetics along the gastrointestinal tract in laying hens. British Poultry Science, 65(5), 605–614.
Huang, S., Rong, X., Liu, M., Liang, Z., Geng, Y., Wang, X., Zhang, J., Ji, C., Zhao, L., & Ma, Q. (2022).Intestinal mucosal immunity-mediated modulation of the gut microbiome by oral delivery of Enterococcus faecium against Salmonella Enteritidis pathogenesis in a laying hen model.Front Immunol., 2022 (13), 853954.
Jeong, S.-B., Kim, Y. B., Lee, J.-W., Kim, D.-H., Moon, B.-H., Chang, H.-H., Choi, Y.-H., & Lee, K.-W. (2020). Role of dietary gamma-aminobutyric acid in broiler chickens raised under high stocking density. Animal Nutrition, 6(3), 293-304.
Jo, M.-H., Hong, S.-J., Lee, H.-N., Ju, J.-H., Park, B.-R., Lee, J.-h., Kim, S.-A., Eun, J.-B., Wee, Y.-J., & Kim,Y.-M. (2019). Gamma-aminobutyric acid production from a novel Enterococcus avium JS-N6B4 strain isolated from edible insects. Poultry Science, 95(12), 2829-2835.
Kalode, V., & Patil, P. (2023). Enterococcus species: a systemic review. Journal of Pure & Applied Microbiology, 17(2).
Khalifa, A., & Ibrahim, H. I. M. (2023). Enterococcus faecium from chicken feces improves chicken immune response and alleviates Salmonella infections: A pilot study. Journal of Animal Science, 101, skad016.
Kierończyk, B., Rawski, M., Długosz, J., Świąkiewicz, S., & Józefiak, D. (2016). Avian crop function–a review. Annals of Animal Science, 16(3), 653-678.
Kim, D.-H., Dasagrandhi, C., Park, S.-K., Eom, S.-H., Huh, M.-K., Mok, J.-S., & Kim, Y.-M. (2018). Optimization of gamma-aminobutyric acid production using sea tangle extract by lactic acid bacterial fermentation. LWT, 90, 636-642.
Kim, D.-H., & Lee, K.-W. (2023). An update on heat stress in laying hens. World's Poultry Science Journal, 79(4), 689-712.
Kim, Y. B., Park, J., Lee, H.-G., Song, J.-Y., Kim, D.-H., Ji, W., Joo, S. S., Kim, M., Jung, J. Y., & Kim, M. (2024). Dietary probiotic Lacticaseibacillus paracasei NSMJ56 modulates gut immunity and microbiota in laying hens. Poultry Science, 103505.
Kolupaev, Y. E., Shakhov, I., Kokorev, A., Dyachenko, A., & Dmitriev, A. (2024). The role of reactive oxygen species and calcium ions in implementing the stress-protective effect of -aminobutyric acid on wheat seedlings under heat stress conditions. Cytology and Genetics, 58(2), 81-91.
Li, T., Luo, B., Zou, X., Yin, J., Lv, S., Wang, J., & Gong, L. (2024). Enterococcus avium from a traditional Chinese liquor fermentation system with the potential for the de novo synthesis of GABA. LWT, 206, 116560.
Mangan, M., & Siwek, M. (2024). Strategies to combat heat stress in poultry production - A review. Journal of Animal Physiology and Animal Nutrition, 108(3), 576-595.
Martínez, S., López, M., & Bernardo, A. (2003). Thermal inactivation of Enterococcus faecium: effect of growth temperature and physiological state of microbial cells. Letters in Applied Microbiology, 37(6), 475-481.
Maasjost J., Mühldorfer K., De Jäckel S.C., & Hafez H.M. (2015). Antimicrobial susceptibility patterns of Enterococcus faecalis and Enterococcus faecium isolated from poultry flocks in Germany. Avian Diseases, 59, 143–148.
Morgan, N., Walk, C., Bedford, M., & Burton, E. (2014). The effect of dietary calcium inclusion on broiler gastrointestinal pH: Quantification and method optimization. Poultry Science, 93(2), 354-363.
Park, J., Jeong, J., Lee, S., & Kim, I. (2016). Effect of dietary supplementation with a probiotic (Enterococcus faecium) on production performance, excreta microflora, ammonia emission, and nutrient utilization in ISA brown laying hens. Poultry Science, 95(12), 2829-2835.
Park, J., & Kim, I. (2015). Effects of dietary gamma-aminobutyric acid on egg production, egg quality, and blood profiles in layer hens. Veterinarni Medicina, 60(11), 629-634.
Phuengjayaem, S., Booncharoen, A., & Tanasupawat, S. (2021). Characterization and comparative genomic analysis of gamma-aminobutyric acid (GABA)-producing lactic acid bacteria from Thai fermented foods. Biotechnology Letters, 43(8), 1637-1648.
Recoules, E., Lessire, M., Labas, V., Duclos, M. J., Combes-Soia, L., Lardic, L., Peyronnet, C., Quinsac, A., Narcy, A., & Réhault-Godbert, S. (2019). Digestion dynamics in broilers fed rapeseed meal. Scientific Reports, 9(1), 3052.
Rodríguez-Sánchez, S., Fernández-Pacheco, P., Seseña, S., Pintado, C., & Palop, M. L. (2021). Selection of probiotic Lactobacillus strains with antimicrobial activity to be used as biocontrol agents in food industry. LWT, 143, 111142.
Ruiz, L., Margolles, A., & Sánchez, B. (2013). Bile resistance mechanisms in Lactobacillus and Bifidobacterium. Frontiers in Microbiology, 4, 396.
Salim, H. M., Huque, K. S., Kamaruddin, K. M., & Beg, M. (2018). Global restriction of using antibiotic growth promoters and alternative strategies in poultry production. Science Progress, 101(1), 52-75.
Shaji, S., Selvaraj, R. K., & Shanmugasundaram, R. (2023). Salmonella infection in poultry: a review on the pathogen and control strategies. Microorganisms, 11(11), 2814.
Sharma, C., Gulati, S., Thakur, N., Singh, B. P., Gupta, S., Kaur, S., Mishra, S. K., Puniya, A. K., Gill, J. P. S., & Panwar, H. (2017). Antibiotic sensitivity pattern of indigenous lactobacilli isolated from curd and human milk samples. 3 Biotech, 7, 1-14.
Sirisopapong, M., Shimosato, T., Okrathok, S., & Khempaka, S. (2023). Assessment of lactic acid bacteria isolated from the chicken digestive tract for potential use as poultry probiotics. Animal Bioscience, 36(8), 1209.
Sobczak, A., & Kozłowski, K. (2015). The effect of a probiotic preparation containing Bacillus subtilis ATCC PTA-6737 on egg production and physiological parameters of laying hens. Annals of Animal Science, 15(3), 711-723.
Špelina, V., Schlemmerová, L., Landfeld, A., Kýhos, K., Měřička, P., & Houška, M. (2007). Thermal inactivation of Enterococcus faecium. Czech Journal of Food Sciences, 25(5), 283.
Tamura, K., Stecher, G., & Kumar, S. (2021). MEGA11: molecular evolutionary genetics analysis version 11. Molecular Biology and Evolution, 38(7), 3022-3027.
Tan, X., Zhang, Q., Liu, J., Shang, Y., Min, Y., Sun, X., & Tang, J. (2024). Enhanced -aminobutyric acid production by co-culture fermentation with Enterococcus faecium AB157 and Saccharomyces cerevisiae SC125. LWT, 208, 116739.
Tancharoenrat, P., Zaefarian, F., & Ravindran, V. (2022). Composition of chicken gallbladder bile. British Poultry Science, 63(4), 548-551.
Xu, Y., Li, D., Ding, X., Wang, Y., Liang, S., Xie, L., Zhang, Y., Fu, A., Yu, W., & Zhan, X. (2023). Probiotic characterization and comparison of broiler-derived lactobacillus strains based on technique for order preference by similarity to ideal solution analysis. Poultry Science, 102(5), 102564.
Yang, B., Huang, S., Zhao, G., & Ma, Q. (2022). Dietary supplementation of porcine bile acids improves laying performance, serum lipid metabolism and cecal microbiota in late-phase laying hens. Animal Nutrition, 11, 283-292.
Yao, L., Lyu, C., Wang, Y., Hu, S., Zhao, W., Cao, H., Huang, J., & Mei, L. (2023). High-level production of -aminobutyric acid via efficient co-expression of the key genes of glutamate decarboxylase system in Escherichia coli. Engineering Microbiology, 3, 100077.
Zhang, M., ZOU, X. t., Li, H., DONG, X. y., & Zhao, W. (2012). Effect of dietary ‐aminobutyric acid on laying performance, egg quality, immune activity and endocrine hormone in heat‐stressed Roman hens. Animal Science Journal, 83(2), 141-147.
Zhang, Q., Xiang, J., Zhang, L., Zhu, X., Evers, J., Werf, W., & Duan, L. 2014. Optimizing soaking and germination conditions to improve gamma-aminobutyric acid content in japonica and indica germinated brown rice. Journal of Functional Foods ,10, 283-291.
Zhou, X., Willems, R. J., Friedrich, A. W., Rossen, J. W., & Bathoorn, E. (2020). Enterococcus faecium: from microbiological insights to practical recommendations for infection control and diagnostics. Antimicrobial Resistance & Infection Control, 9, 1-13.
Zhu, Y., Cheng, J., Ren, M., Yin, L., & Piao, X. (2015). Effect of -aminobutyric acid-producing Lactobacillus strain on laying performance, egg quality and serum enzyme activity in Hy-Line brown hens under heat stress. Asian-Australasian Journal of Animal Sciences, 28(7), 1006.
Zommiti, M., Chevalier, S., Feuilloley, M.G.J., & Connil, N. (2022). Special Issue "Enterococci for probiotic use: safety and risk": Editorial. Microorganisms, 10(3), 604.
ดาวน์โหลด
เผยแพร่แล้ว
รูปแบบการอ้างอิง
ฉบับ
ประเภทบทความ
สัญญาอนุญาต
ลิขสิทธิ์ (c) 2025 คณะวิทยาศาสตร์ มหาวิทยาลัยบูรพา

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
Burapha Science Journal is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International (CC BY-NC-ND 4.0) licence, unless otherwise stated. Please read our Policies page for more information



